競争反応においては,
\(\Large \require{AMScd} \begin{CD} B @>>k_A> A \\
@VVk_CV\\C \end{CD} \)
という反応を考えていきましょう.
ここ,で示したように,Bは二つの反応経路があるので,
\(\Large k_A + k_B \)
で反応が進みます.つまり,
kA = 1 (1/s), kB = 1 (1/s)
の場合,BはkA+KBの速度で減少することになるのです.上記の反応速度では0.5秒となります.
では,A, Cはどうでしょう?
上記のようにそれぞれ,
kA = 1 (1/s), kB = 1 (1/s)
ですので,A,Cへ行く平均反応時間はそれぞれ1秒となります.
となると,すべての反応の平均時間は1秒となります.
しかし,上記のように,Bは0.5秒なのでおかしいですね...
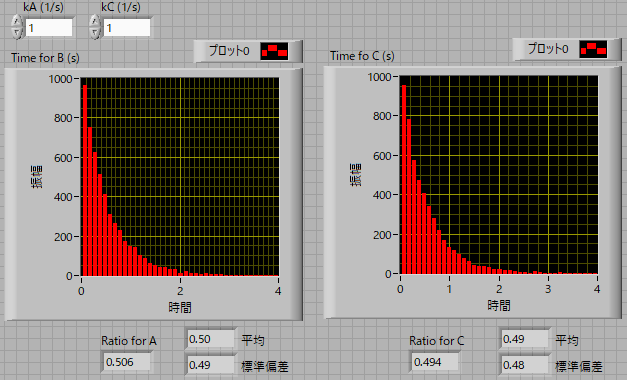
モンテカルロシュミレーションにて確認してみましょう.

結果はなんと,それぞれの反応にかかる時間が0.5秒となっています(図の下の”平均”を確認ください).
kA = 1 (1/s), kB = 1 (1/s)
にも関わらず....
次ページにに,この問題を考えていきましょう.